Oorspronkelijk artikel
De Dutch Parkinson Cohort (DUPARC) studie
- 18-02-2025
- Leestijd: 4 minuten
E. De Meyer, MD 1,2;S. Van der Zee, MSc, PhD 3; S. Slingerland, MD 3; A.K.. Dortmond, MSc 3; G. N. Stormezand, MD, PhD 2; S.K. Meles, MD, PhD 3; prof. T. Van Laar MD, PhD 3
1Afdeling Nucleaire Geneeskunde, Universitair Ziekenhuis Gent, Gent, België, 2Afdeling Nucleaire Geneeskunde, Universitair Medisch Centrum Groningen, 3Afdeling Neurologie, Universitair Medisch Centrum Groningen
De DUPARC studie
De Dutch Parkinson Cohort (DUPARC) studie is een monocentrische, prospectieve, observationele studie waarin data verzameld werd van 150 de novo PD patiënten die nog geen behandeling kregen bij baseline, met follow-up onderzoeken na een jaar en na drie jaar. Deelnemers werden geïncludeerd via het Parkinson Platform Noord Nederland (PPNN) en doorgestuurd naar het Universiteit Medisch Centrum Groningen (UMCG) waar klinische data verzameld werd via verschillende vragenlijsten, motorisch onderzoek, neuropsychologisch onderzoek, bloedonderzoek, fecesonderzoek, genetische screening, en uitgebreide beeldvorming met 18F-dihydroxyphenylalanine ([18F]FDOPA), 18F-fluoroethoxybenzovesamicol ([18F]FEOBV) PET en structurele en functionele MRI. Een volledig overzicht van de vragenlijsten en onderzoeken kan teruggevonden worden in de protocol paper van de DUPARC studie (3).
Nucleaire beeldvorming in de DUPARC studie
Nucleaire beeldvorming speelt een centrale rol in de DUPARC studie. Met behulp van [18F]FDOPA PET en [18F]FEOBV PET worden respectievelijk de dopaminerge en cholinerge systemen in beeld gebracht, waardoor we betere inzichten kunnen krijgen in de neurobiologische veranderingen in de hersenen bij de ziekte van Parkinson.
Het verlies van dopamine producerende neuronen in de substantia nigra is kenmerkend voor de ziekte van Parkinson en leidt tot een geleidelijk verlies van dopaminerge innervatie in het striatum wat een belangrijke rol speelt bij het ontstaan van de typische motorische symptomen (4). Dit proces begint doorgaans asymmetrisch, contralateraal aan de kant waar de eerste klinische motorische symptomen merkbaar zijn (5). De striatale dopaminerge degeneratie start typisch in het posterieure putamen, en breidt zich vervolgens uit naar het anterieure putamen, het dorsale caudatus en uiteindelijk ook het ventrale striatum (6). Bij deze neurodegeneratieve aandoening zijn ook dopaminerge veranderingen buiten het striatum waargenomen, maar het belang hiervan is op heden nog niet helemaal duidelijk (7). [18F]FDOPA PET maakt het mogelijk om presynaptische dopaminerge innervatie in beeld te brengen. De tracer volgt dezelfde weg als endogeen dopamine en wordt opgenomen in het neuron. Daar wordt het omgezet naar [18F]dopamine door aromatisch L-aminozuur-decarboxylase en wordt vervolgens opgeslagen in presynaptische vesikels (8) (figuur 1). In de klinische praktijk wordt deze tracer routinematig gebruikt om een presynaptisch dopaminerg defect aan te tonen, wat belangrijk is in de differentiaal diagnose tussen neurodegeneratief parkinsonisme en parkinsonisme van andere origine (bijvoorbeeld medicamenteus, vasculair of psychogeen) (9).
Naast het dopaminerge systeem speelt ook cholinerge transmissie een belangrijke rol in de ziekte. Dit systeem reguleert verschillende functies van menselijk gedrag, zoals cognitie, motorische controle en slaap (10). Bij PD is verstoring van de cholinerge transmissie geassocieerd met cognitieve achteruitgang, loopproblemen, freezing, vallen, REM-slaapgedragsstoornis (RBD), neuropsychiatrische manifestaties en reukstoornissen (11). Het cholinerg systeem is reeds in een vroeg stadium van de ziekte betrokken, zelfs voorafgaand aan het optreden van motorische symptomen (11).
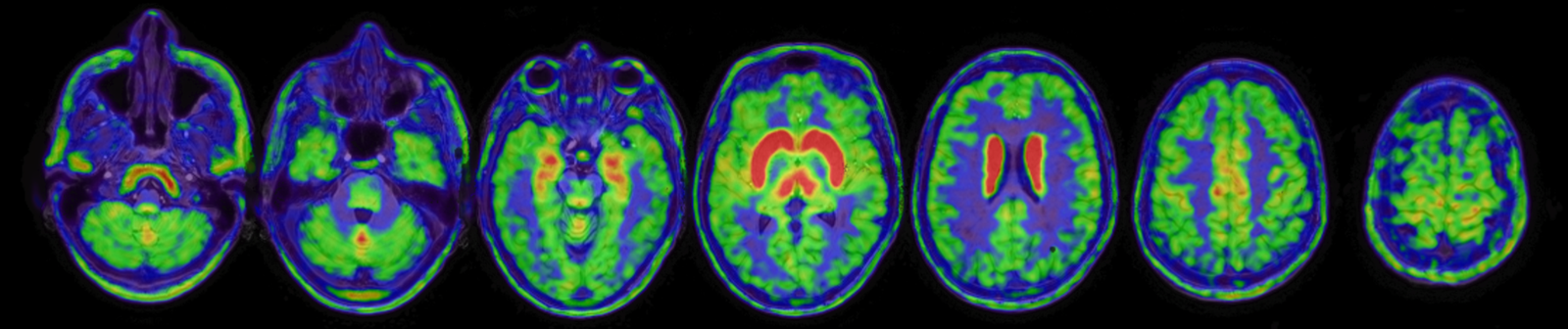
[18F]FEOBV bindt zich aan de vesiculaire acetylcholine-transporter (VAChT), een eiwit dat bijna alleen voorkomt in presynaptisch cholinerge zenuwuiteinden en verantwoordelijk is voor het transporteren van acetylcholine in de presynaptische vesikels (figuur 1). Hiermee biedt deze tracer een directe maat voor de integriteit van cholinerge zenuwuiteinden, in tegenstelling tot indirecte markers zoals acetylcholinesterase (AChE). Bij gezonde personen toont [18F]-FEOBV een verdeling in de hersenen die overeenkomt met de bekende anatomie van cholinerge zenuwen, met de hoogste concentraties in het striatum, gevolgd door de thalamus, cerebellaire vermis, amygdala, hippocampus en cerebrale cortex (12) (figuur 2). Op dit moment wordt deze tracer voornamelijk gebruikt in het kader van wetenschappelijk onderzoek en zijn er verdere studies nodig om de bruikbaarheid en validiteit van de tracer in een klinische setting te evalueren.
Voor zowel [18F]FDOPA als [18F]FEOBV PET beeldvorming kan gebruik gemaakt worden van een laattijdige statische scanningsprocedure, waarmee resultaten behaald worden die sterk correleren met meer complexe scanningsmethoden (12,13). Door gebruik te maken van ratio’s ten opzichte van een stabiele referentieregio kan een kwantificatie bekomen worden van de integriteit van presynaptische dopaminerge en cholinerge neuronen, zonder de noodzaak van volledige kinetische modellering. Deze methode zorgt voor een minder grote belasting voor patiënten ten opzichte van een volledige compartimentele kinetische analyse met een dynamisch scanningsprotocol, wat met name relevant is naargelang de ziekte vordert en patiënten kwetsbaarder worden.
Resultaten uit de DUPARC studie
De verzamelde data van het DUPARC cohort hebben reeds waardevolle inzichten opgeleverd over de rol van cholinerge innervatie en de impact ervan op het klinisch beeld in de vroegtijdige fase van PD. Zo werd er vastgesteld dat er al significante veranderingen in cholinerge innervatie optreden bij de novo PD-patiënten, en dit zowel bij patiënten met een cognitieve stoornis als bij cognitief intacte patiënten. Dit wijst op een algemene cholinerge denervatie, met name in de posterieure corticale gebieden, dat al aanwezig is in het begin van de ziekte ongeacht de cognitieve status (14). Daarnaast werd bij cognitief intacte patiënten een verhoogde cholinerge binding waargenomen in cerebellaire en subcorticale regio’s ten opzichte van gezonde vrijwilligers, wat kan wijzen op een compenserende upregulatie van het cholinerge systeem in de vroege stadia van de ziekte (14).
De meest voorkomende genetische risicofactor voor het ontwikkelen van de ziekte van Parkinson is een mutatie in het GBA1-gen, dat codeert voor het enzym glucocerebrosidase. Dit wordt geassocieerd met een jongere leeftijd bij diagnose en een snellere progressie van de ziekte, vaak met ernstigere cognitieve stoornissen (15). Binnen de DUPARC studie werd bij de novo PD patiënten met GBA1-mutaties meer wijdverspreide cholinerge denervatie waargenomen in vergelijking met patiënten zonder deze mutaties ten opzichte van gezonde controles (16). Deze bevindingen suggereren dat de cholinerge veranderingen mogelijk eerder optreden en uitgebreider zijn bij PD patiënten met een GBA1-mutatie, wat kan bijdragen tot de snellere ziekteprogressie die bij deze patiëntengroep gezien wordt.
Ook met onderzoeken buiten nucleaire beeldvorming werden reeds belangrijke resultaten bekomen uit de DUPARC studie. Zo werd aangetoond dat het microbioom significant verschilt bij patiënten met de ziekte van Parkinson, ten opzichte van gezonde vrijwilligers, en dit reeds in het de novo stadium zonder de invloed van dopaminerge medicatie (17). Daarnaast werd met optische coherentie tomografie (OCT) vastgesteld dat de dikte van de retina bij de novo PD patiënten significant dunner is dan bij gezonde vrijwilligers, in een meer uitgebreid en wijdverspreid patroon dan gezien wordt bij glaucoom (18).
Toekomst
De follow-up ronde van de DUPARC studie drie jaar na diagnose, waaraan 119 deelnemers hebben deelgenomen, werd recent succesvol afgerond. De nieuwe follow-up ronde is inmiddels gestart, waarbij de eerste deelnemers nu zes jaar na hun initiële diagnose opnieuw zijn onderzocht. Het doel is om deze follow-up rondes elke drie jaar te blijven herhalen. De DUPARC studie zal zo belangrijke inzichten kunnen bieden in het longitudinale verloop van de ziekte van Parkinson en de daarmee samenhangende neurobiologische veranderingen. De combinatie van beeldvorming met klinische, biologische en genetische gegevens zal verder bijdragen aan een beter begrip van het ziekteverloop en maakt het mogelijk om patronen in ziekteprogressie te identificeren. Dit kan waardevolle perspectieven bieden voor toekomstige interventies die gericht zijn op het vertragen van de ziekte en het verbeteren van de levenskwaliteit, afgestemd op de behoeften van de individuele patiënt.
Referenties
- Postuma RB, Berg D, Stern M, et al. MDS clinical diagnostic criteria for Parkinson’s disease. Mov Disord. 2015;30(12):1591-601
- Berg D, Postuma RB, Adler CH, et al. MDS research criteria for prodromal Parkinson’s disease. Mov Disord. 2015;30(12):1600-11
- Boertien JM, van der Zee S, Chrysou A, et al. Study protocol of the DUtch PARkinson Cohort (DUPARC): a prospective, observational study of de novo Parkinson’s disease patients for the identification and validation of biomarkers for Parkinson’s disease subtypes, progression and pathophysiology. BMC Neurology. 2020;20(1):245
- Morris HR, Spillantini MG, Sue CM, Williams-Gray CH. The pathogenesis of Parkinson’s disease. Lancet. 2024;403(10423):293-304
- Djaldetti R, Ziv I, Melamed E. The mystery of motor asymmetry in Parkinson’s disease. Lancet Neurol. 2006;5(9):796-802
- Fu JF, Wegener T, Klyuzhin IS, et al. Spatiotemporal patterns of putaminal dopamine processing in Parkinson’s disease: A multi-tracer positron emission tomography study. Neuroimage Clin. 2022;36:103246
- Moore RY, Whone AL, Brooks DJ. Extrastriatal monoamine neuron function in Parkinson’s disease: an 18F-dopa PET study. Neurobiol Dis. 2008;29(3):381-90
- Firnau G, Garnett ES, Chirakal R, et al. [18F]fluoro-L-dopa for the in vivo study of intracerebral dopamine. Int J Rad Appl Instrum A. 1986;37(8):669-75
- Morbelli S, Esposito G, Arbizu J, et al. EANM practice guideline/SNMMI procedure standard for dopaminergic imaging in Parkinsonian syndromes 1.0. Eur J Nucl Med Mol Imaging. 2020;47(8):1885-912
- Picciotto MR, Higley MJ, Mineur YS. Acetylcholine as a neuromodulator: cholinergic signaling shapes nervous system function and behavior. Neuron. 2012;76(1):116-29
- Pasquini J, Brooks DJ, Pavese N. The Cholinergic Brain in Parkinson’s Disease. Mov Disord Clin Pract. 2021;8(7):1012-26
- Petrou M, Frey KA, Kilbourn MR, et al. In vivo imaging of human cholinergic nerve terminals with (-)-5-(18)F-fluoroethoxybenzovesamicol: biodistribution, dosimetry, and tracer kinetic analyses. J Nucl Med. 2014;55(3):396-404
- Jokinen P, Helenius H, Rauhala E, Brück A, Eskola O, Rinne JO. Simple ratio analysis of 18F-fluorodopa uptake in striatal subregions separates patients with early Parkinson disease from healthy controls. J Nucl Med. 2009;50(6):893-9
- van der Zee S, Kanel P, Gerritsen MJJ, et al. Altered Cholinergic Innervation in De Novo Parkinson’s Disease with and Without Cognitive Impairment. Mov Disord. 2022;37(4):713-23
- Winder-Rhodes SE, Evans JR, Ban M, et al. Glucocerebrosidase mutations influence the natural history of Parkinson’s disease in a community-based incident cohort. Brain. 2013;136(Pt 2):392-9
- Slingerland S, van der Zee S, Carli G, et al. Cholinergic innervation topography in GBA-associated de novo Parkinson’s disease patients. Brain. 2024;147(3):900-10
- Boertien JM, Murtomäki K, Pereira PAB, et al. Fecal microbiome alterations in treatment-naive de novo Parkinson’s disease. NPJ Parkinsons Dis. 2022;8(1):129-8
- Chrysou A, Heikka T, van der Zee S, et al. Reduced Thickness of the Retina in de novo Parkinson’s Disease Shows A Distinct Pattern, Different from Glaucoma. J Parkinsons Dis. 2024;14(3):507-19
Samenvatting
Introductie
De ziekte van Parkinson (PD) is een van de meest voorkomende neurodegeneratieve aandoeningen wereldwijd. De diagnose van PD kan worden gesteld bij aanwezigheid van de typische motorsymptomen, namelijk bradykinesie, rigiditeit en/of rusttremor (1). Naast deze typische symptomen bestaan echter ook een hele reeks belangrijke niet-motorische symptomen zoals cognitieve achteruitgang, gastro-intestinale stoornissen, visuele stoornissen, depressie, apathie, slaapproblemen, en autonome stoornissen. Deze niet-motorische klachten kunnen in elk stadium van de ziekte optreden, maar kunnen ook vooraf gaan aan de typische motorische symptomen (2). De symptomen bij PD zijn heterogeen en verschillende klinische subtypes kunnen worden onderscheiden, elk met een unieke combinatie en ernst van symptomen. Dit wijst op mogelijke variaties in de onderliggende pathofysiologische mechanismen van de PD-subtypes.
Momenteel zijn er enkel symptomatische behandelingen beschikbaar, die voornamelijk gericht zijn op het verlichten van motorsymptomen. Ondanks veelbelovende targets, intensief onderzoek en belangrijke vorderingen in de afgelopen decennia, is er tot op heden geen ziekte-modificerende therapie voor de ziekte van Parkinson beschikbaar. Een mogelijke verklaring hiervoor is dat er in klinische studies vaak geen rekening wordt gehouden met de verschillende subtypes van PD die patiënten kunnen hebben. De heterogeniteit van de ziekte maakt het moeilijk om een universele ziekte-modificerende therapie te ontwikkelen die bij alle patiënten effectief is. Daarnaast ontbreekt een strategie om patiënten op basis van subtype te selecteren voor klinische studies, wat het ontwikkelen en testen van gerichte therapieën bemoeilijkt. Om de verschillende subtypes van PD en hun progressie beter te kunnen herkennen en behandelen, werd in 2017 het DUPARC-cohort opgericht.