PROEFSCHRIFT
[18F]MC225 and PET: in vivo measurements of the P-glycoprotein function at the human blood-brain barrier
- 24-09-2025
P-glycoproteïne (P-gp), ook wel multidrug resistance protein 1 (MDR1 of ABCB1), is een
transporter-eiwit op de bloed-hersenbarrière. De transporter is verantwoordelijk voor de klaring van verschillende neurotoxische stoffen uit het brein en lijkt hiermee een belangrijke rol te spelen bij de ontwikkeling van verschillende neurodegeneratieve aandoeningen, zoals de ziekte van Alzheimer en de ziekte van Parkinson. Ook is P-gp betrokken bij de opname van verschillende geneesmiddelen in het brein en kunnen veranderingen in zijn functie leiden tot resistentie voor geneesmiddelen of ongewenste bijwerkingen. Om de functie van P-glycoproteïne in kaart te brengen werd de nieuwe PET tracer [18F]MC225 ontwikkeld. [18F]MC225 is een substraat van P-gp, wat betekent dat de tracer over de bloed-hersenbarrière uit het brein wordt getransporteerd. De functie van P-gp kan dan indirect worden gemeten door de resterende opname in het hersenparenchym te analyseren. [18F]MC225 werd in 2015 voor het eerst bestudeerd door Savolainen et al, in een vergelijkingsstudie in vitro waarin meerdere P-gp substraten getest werden op affiniteit en specificiteit. Hieruit werd geconcludeerd dat [18F]MC225 een zwak substraat is van P-glycoproteïne, wat betekent dat de opname van deze PET tracer op baseline niveau in het brein hoger is dan bij sterkere substraten. Hierdoor heeft [18F]MC225 de potentie om niet alleen afname in P-gp functie te meten, zoals nu gebruikte P-gp PET tracers als [11C]verapamil, maar ook toenames.
Het doel van dit proefschrift was het valideren van [18F]MC225 als specifieke meet-methode voor de P-gp functie van de bloed-hersenbarrière door het onderzoeken van de PET-tracer in dierstudies, gezonde vrijwilligers en in patiënten met de ziekte van Alzheimer. De uitkomsten van deze studies werden in verschillende hoofdstukken beschreven en toegelicht:
In de inleiding van het proefschrift werd de huidige kennis over P-gp in de bloed-hersenbarrière belicht, met speciale aandacht voor de impact van veranderingen in P-gp functie op psychiatrische en neurologische aandoeningen en de invloed van deze transporter op geneesmiddelen en geneesmiddelresistentie. Veranderingen in P-gp functie worden geassocieerd met diverse neurodegeneratieve en psychiatrische aandoeningen, waaronder de ziekte van Alzheimer, de ziekte van Parkinson, epilepsie, depressie en schizofrenie. Een meerderheid van de geneesmiddelen die worden gebruikt bij de behandeling van psychiatrische en neurologische aandoeningen hebben een zwakke, matige of hoge affiniteit als P-gp substraten of P-gp remmers en veranderingen in P-gp functie kunnen hierdoor aanzienlijke effecten hebben op de behandeluitkomst. De rol van P-gp in zowel de pathofysiologie van ziekten als geneesmiddelresistentie maakt P-gp een interessant doelwit voor de in vivo metingen die gedaan kunnen worden middels PET.
Vervolgens werd de sensitiviteit van [18F]MC225 voor subtiele veranderingen in P-gp functie geëvalueerd in een preklinische dierstudie. Er werd gebruik gemaakt van dosisafhankelijke inhibitie van P-gp functie door middel van tariquidar. In deze studie werd aangetoond dat het mogelijk is om met [18F]MC225 kleine veranderingen in P-gp functie te identificeren. Deze hoge gevoeligheid voor kleine veranderingen is van groot belang voor verschillende klinische toepassingen waarbij de P-gp functie slechts minimaal is veranderd, zoals de diagnostiek van neurodegeneratieve ziekten in een zeer vroeg stadium en de detectie van veranderingen in P-gp functie als gevolg van veroudering.
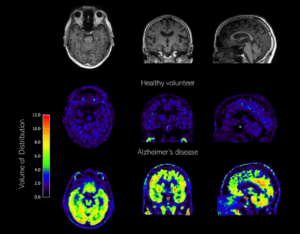 In een vervolgstudie werd vervolgens de farmacokinetiek, test-retest variabiliteit en specificiteit van [18F]MC225 onderzocht in een van de eerste humane [18F]MC225 studies. Verschillende farmacokinetische modellen werden getest en uiteindelijk werd het reversibele two tissue-compartimentmodel (2T4K) geselecteerd als voorkeursmodel en het distributievolume (VT) als meest optimale parameter. De VT vertegenwoordigt de verhouding van de radioligand-concentratie in het doelweefsel ten opzichte van die in plasma bij evenwicht, en correspondeert omgekeerd evenredig met de P-gp functie. Met het gebruik van dit model toonde [18F]MC225 een relatief hoge test-retest variabiliteit van 28%.
In een vervolgstudie werd vervolgens de farmacokinetiek, test-retest variabiliteit en specificiteit van [18F]MC225 onderzocht in een van de eerste humane [18F]MC225 studies. Verschillende farmacokinetische modellen werden getest en uiteindelijk werd het reversibele two tissue-compartimentmodel (2T4K) geselecteerd als voorkeursmodel en het distributievolume (VT) als meest optimale parameter. De VT vertegenwoordigt de verhouding van de radioligand-concentratie in het doelweefsel ten opzichte van die in plasma bij evenwicht, en correspondeert omgekeerd evenredig met de P-gp functie. Met het gebruik van dit model toonde [18F]MC225 een relatief hoge test-retest variabiliteit van 28%.
Ondanks deze hoge test-retest variabiliteit werden na toediening van cyclosporine, een specifieke P-gp inhibitor, een significante verhoging van de VT van gemiddeld 46% gevonden, welke substantieel genoeg bleek om de test-retest variabiliteit te overstemmen.
Voor de farmacokinetische analyses die werden uitgevoerd in dit proefschrift was gedurende de PET-scans invasieve arteriële bloedafname nodig om een adequate inputcurve te genereren. Om een manier te vinden om deze bloedafnameprocedures te vermijden, werd in een review-artikel de correlatie tussen verschillende potentiële niet-invasieve methoden voor het genereren van kinetische inputfuncties (PBIF, IDIF, SIME) en de gevestigde gouden standaard van arteriële bloedafname voor PET-hersenstudies beoordeeld. Er werd op basis van deze review geconcludeerd dat voor een niet-invasieve [18F]MC225 analyse een image derived input function (IDIF) wellicht goede resultaten zou kunnen opleveren en deze methode werd vervolgens geëvalueerd in veertien gezonde proefpersonen. De uitkomsten tussen de AIF en IDIF input curves werden vergeleken en lieten helaas slechts een zwakke correlatie zien, welke wellicht werd veroorzaakt door de relatief kleine omvang van de carotiden en de gelimiteerde spatiele resolutie van de gebruikte PET scanner. Op het moment van schrijven loopt een vervolgstudie op de Vision Quadra met een grotere field of view, waardoor het brein en de aorta tegelijk dynamisch gescand kunnen worden en de activiteit in het grotere bloed volume in de aorta als basis voor de inputcurve gebruikt kan worden.
Het sluitstuk van het proefschrift was een nog lopende studie waarin [18F]MC225 getest werd in een groep patiënten met de ziekte van Alzheimer. Er werd een VT toename van 52,1% gevonden ten opzichte van een overeenkomende groep gezonde vrijwilligers. Met deze eerste positieve resultaten legt deze studie een goede basis voor toekomstige studies naar andere neurodegeneratieve en psychiatrische aandoeningen.
Conclusies en toekomstperspectieven
Samenvattend werd in dit proefschrift aangetoond dat [18F]MC225 PET-beeldvorming accuraat en veilig toegepast kan worden in de mens en dat het mogelijk is adequaat verschillen te meten in P-gp functie met deze nieuwe PET tracer. Echter, kwantificatie van de P-gp functie middels het farmacokinetisch modelleren van de tracer blijft tot nu toe nog essentieel voor de interpretatie van [18F]MC225 PET data, aangezien vereenvoudigde analytische benaderingen tot dusver niet nauwkeurig zijn gebleken voor accurate metingen. De uitkomsten van de studies in dit proefschrift hebben de eerste stappen gezet in het bestuderen van deze nieuwe PET tracer in de mens, waarmee de fundering werd gelegd voor gebruik van de tracer voor andere toepassingen, zoals de evaluatie van therapieresistentie voor bepaalde geneesmiddelen, geneesmiddelontwikkeling en (vroege) pathofysiologische diagnostiek bij diverse neurologische en psychiatrische aandoeningen.
Pascalle Mossel, PhD

Pascalle Mossel, PhD
14 oktober 2024
Rijksuniversiteit Groningen
Promotores:
Prof. Dr. R.A.J.O. Dierckx, MD, PhD
prof. P.P. de Deyn, MD, PhD
G. Luurtsema, PhD
Co-promotor:
A.L. Bartels, PhD