PROEFSCHRIFT
Multimodale beeldvorming voor het personaliseren van sarcoomzorg
- 24-09-2025
[18F]FDG-PET en sarcomen
Elk jaar wordt bij ongeveer achthonderd patiënten in Nederland een sarcoom, een kwaadaardige bot- en wekedelen tumor, gediagnosticeerd (1). Ondanks deze relatief lage incidentie is onderzoek naar de ziekte van groot belang. Veelal zijn patiënten jong, kind of adolescent, en de vijfjaarsoverleving ten tijde van diagnosestelling is slechts een krappe zestig procent (2). Behandeling van de patiëntengroep is complex, onder andere door de heterogeniteit van de ruim honderdvijftig verschillende subtypes sarcomen die worden beschreven in de World Health Organisation Classification of Soft Tissue and Bone Tumours (3). De afgelopen decennia heeft het karakteriseren van tumorweefsel met medische beeldvorming de zorg voor patiënten met een bot- en wekedelen tumoren verbeterd. Diagnostisering van het type tumor, stadiëring van de uitgebreidheid van ziekte en het monitoren van de reactie op therapie zijn allen deels of volledig afhankelijk van beeldvorming. Er zijn nog veel openstaande vragen over welke beeldvormingsmodaliteit voor welk type sarcoom de meeste relevante informatie biedt, en hoe deze beelden het beste kunnen worden afgelezen, geanalyseerd en geïnterpreteerd (4). Dit biedt ruimte voor verder onderzoek. Voor artsen is het de uitdaging om zowel de sarcomen als groep van tumoren beter te begrijpen, als de eigenschappen van individuele tumorlaesies. Dit inzicht is cruciaal voor het opstellen van gepersonaliseerde behandelplannen in de toekomst. In mijn proefschrift heb ik de potentie van [18F]FDG-PET scans om de zorg voor patiënten met een bot- en wekedelentumor te verbeteren geëxploreerd, en methodes ontwikkeld om onderzoek in de toekomst te optimaliseren.
De waarde van [18F]FDG-PET parameters
Momenteel worden [18F]FDG-PET scans ingezet bij geselecteerde patiënten om tumorlokaties van sarcomen met onvoorspelbare metastaseringspatronen, zoals angio- of rhabdomyosarcoom, te identificeren. Daarnaast worden deze scans gebruikt voor het monitoren van het effect van therapie, bijvoorbeeld TKI-behandeling bij patiënten met gemetastaseerde GIST en chemotherapie bij gemetastaseerd sarcoom (5). De grote hoeveelheid informatie die een PET scan biedt, kan in theorie nog veel meer waardevolle gegevens opleveren voor behandelaren. Een voorbeeld hiervan is het kwantificeren van tumoreigenschappen op [18F]FDG-PET scans, die gemaakt worden om de ziekte te stadiëren bij patiënten met gemetastaseerd wekedelen sarcoom. In een retrospectieve studie vond onze onderzoeksgroep een associatie tussen de mate van [18F]FDG stapeling in tumorweefsel en de overleving van deze patiënten (6), zie figuur 1. Deze prognostische [18F]FDG-PET parameters kunnen zowel patiënt als behandelaar helpen bij het maken van complexe behandelkeuzes.
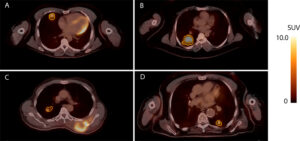 Figuur 1. Voorbeelden van [18F]FDG-PET/CT scans van patiënten met longmetastasen van wekedelensarcomen met verschillende metabole kenmerken. VOI’s (volumes of interest) zijn in oranje omlijnd. (A) Een metastase met een SUVmax van 6,1, vastgesteld 22 maanden na resectie van een ongedifferentieerd wekedelensarcoom in de rechter m. deltoïdeus; (B) Een metastase met een SUVmax van 9,0, vastgesteld 34 maanden na resectie van een ongedifferentieerd wekedelensarcoom in de rechter gluteus maximus; (C) Een metastase met een SUVmax van 5,2, gelijktijdig vastgesteld met een myxofibrarcoom afkomstig van de linker thoraxwand; (D) E metastase met een SUVmax van 7,2, gelijktijdig vastgesteld met een lokaal recidief van een leiomyosarcoom in het rechteronderbeen.
Figuur 1. Voorbeelden van [18F]FDG-PET/CT scans van patiënten met longmetastasen van wekedelensarcomen met verschillende metabole kenmerken. VOI’s (volumes of interest) zijn in oranje omlijnd. (A) Een metastase met een SUVmax van 6,1, vastgesteld 22 maanden na resectie van een ongedifferentieerd wekedelensarcoom in de rechter m. deltoïdeus; (B) Een metastase met een SUVmax van 9,0, vastgesteld 34 maanden na resectie van een ongedifferentieerd wekedelensarcoom in de rechter gluteus maximus; (C) Een metastase met een SUVmax van 5,2, gelijktijdig vastgesteld met een myxofibrarcoom afkomstig van de linker thoraxwand; (D) E metastase met een SUVmax van 7,2, gelijktijdig vastgesteld met een lokaal recidief van een leiomyosarcoom in het rechteronderbeen.
De (spatiële) link met tumorbiologie
Van veel biologische verschillen tussen tumoren is nog onbekend hoe deze zich precies laten herkennen op beeldvorming. Zo kan verandering als gevolg van radiotherapie zich in wekedelensarcomen presenteren als fibrose, hyalinisatie of necrose, maar kunnen we die entiteiten op beeldvorming niet goed onderscheiden. Om radiologische parameters te vinden die dit onderscheid wel mogelijk maken, hebben wij een interdisciplinaire onderzoeksmethode ontwikkeld. Hierbij worden gedigitaliseerde histologische coupes ruimtelijk geregistreerd aan de hand van radiologische en nucleair geneeskundige beelden (7). We maken hiervoor gebruik van 3D-geprinte tumormallen zodat pathologische verwerking van gereseceerde tumoren exact in een vooraf geselecteerd vlak kan plaatsvinden. Met de data die hieruit voortkomt kan histologie-gestuurde multimodale beeldanalyse verricht worden. Met deze methode worden twee belangrijke limiterende factoren in radiologisch onderzoek naar sarcomen omzeild, namelijk tumorheterogeniteit en het gebrek aan ruimtelijke correlatie van met een histologische referentie. De eerste resultaten van twintig onderzochte sarcomen suggereren dat combinaties van parameters uit [18F]FDG-PET scans, dynamische MRI en diffusiegewogen MRI het mogelijk maken om fibrose, hyalinisatie en necrose te herkennen én van elkaar te onderscheiden.
Harmonisatie van scans
Met het extraheren van steeds complexere radiologische parameters neemt het belang van betrouwbare en nauwkeurige kwantificatie toe. Om kwantitatieve radiologische modellen voor patiënten met een sarcoom in meerdere ziekenhuizen te kunnen implementeren en valideren hebben wij een beeldvormingsfantoom ontwikkeld dat heterogeniteit in aankleuringspatronen, en dus de eigenschappen van een sarcoom, simuleert (8), zie figuur 2. In verband met de opkomst van hybride beeldvormingstechnieken zoals PET/CT en PET/MRI, en met onze eigen bevindingen dat combinaties van beeldvormingsmodaliteiten meer inzicht kunnen geven in tumorbiologie, is het fantoom zo ontwikkeld dat het op de meest voorkomende beeldvormingsmodaliteiten kan worden ingezet. Het 3D-geprinte fantoom is succesvol getest op [18F]FDG-PET, [99mTc]Tc-SPECT, CT, en T1-gewogen MRI. Onze eerste validatiestudie met het fantoom toont dat voor de drie modaliteiten die het meest worden gebruikt in onderzoek naar sarcomen, CT, MRI en [18F]FDG-PET, er 73 van de 93 geteste kwantitatieve textuurkarakteristieken – vaak radiomics genoemd – beschouwd kunnen worden als goed herhaalbaar, ongeacht mate van heterogeniteit van het gescande fantoom. Deze bevindingen suggereren dat het fantoom in toekomstige studies goed gebruikt kan worden voor harmonisatie van scans van patiënten met een sarcoom.
Deep learning algoritmes voor [18F]FDG-PET reconstructie
Nieuwe methodes voor beeldreconstructie voor [18F]FDG-PET die gebruik maken van deep learning of kunstmatige intelligentie om kosten en tijd te besparen, zijn in opkomst in de wetenschap en kliniek. Dit roept een belangrijk vraagstuk op voor radiologisch onderzoek, omdat het effect van deze methodes op de kwantitatieve parameters die gebruikt worden voor beeldanalyse nog onbekend is. In een studie aan de Universiteit van Oxford, waar deep learning gestuurde reconstructie algoritmes voor [18F]FDG-PET scans verkregen op GE scanners al in de kliniek worden gebruikt, hebben wij met ons fantoom aangetoond dat deze nieuwe reconstructiemethoden inderdaad een groot effect hebben op 30 tot 40% van de radiomics (9). Toch geldt voor het overgrote deel van de radiomics, 96% in fantoom scans en 90% in sarcoom scans, dat de waardes vergelijkbaar zijn wanneer de scan met deep learning of de gouden standaard is gereconstrueerd. Deze resultaten geven inzicht in de prestaties van op deep learning gebaseerde reconstructie algoritmes en laten zien dat er veel potentie is voor het gebruik van deep learning bij de harmonisatie van beelden in toekomstige sarcoomstudies.
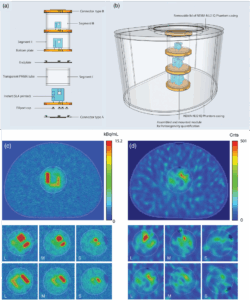 Figuur 2. A) Schematisch overzicht van het fantoom met drie segmenten/inzetstukken om verschillende gradaties van heterogeniteit na te bootsen; (B) Geassembleerd fantoom in een NEMA-NU2 IQ casing; Gedetailleerde afbeeldingen van (C) PET en (D) SPECT beelden van de grote (L), middelgrote (M) en kleine (S) inzetstukken, allemaal in dezelfde oriëntatie uitgelijnd.
Figuur 2. A) Schematisch overzicht van het fantoom met drie segmenten/inzetstukken om verschillende gradaties van heterogeniteit na te bootsen; (B) Geassembleerd fantoom in een NEMA-NU2 IQ casing; Gedetailleerde afbeeldingen van (C) PET en (D) SPECT beelden van de grote (L), middelgrote (M) en kleine (S) inzetstukken, allemaal in dezelfde oriëntatie uitgelijnd.
Conclusie
Kwantitatieve beeldvorming bij sarcomen is complex vanwege de zeldzaamheid en heterogeniteit van de tumoren. Als gevolg hiervan is de klinische implementatie van onderzoeksbevindingen en predictiemodellen uitdagend. In toekomstige studies, vooral die waarbij gebruik wordt gemaakt van kunstmatige intelligentie, moeten zorgvuldige overwegingen worden gemaakt ten aanzien van de opbouw van cohorten en onderzoeksmethodes met inachtneming van tumorbiologie. Harmonisatie van beeldvormingsprotocollen en data is hierbij cruciaal, en fantoomstudies zijn noodzakelijk om klinische modellen bestand te maken tegen nieuwe ontwikkelingen in software en hardware. Tot slot verwachten wij dat onderzoeksmethoden, zoals de door ons voorgestelde ruimtelijke correlatie van multimodale beeldvorming met histologische data, ons zal helpen de betekenis van kwantitatieve beeldvormingsparameters bij sarcomen en daarmee onderliggende biologische mechanismen verder te ontrafelen.
Referenties
- Stiller CA, et al. Descriptive epidemiology of sarcomas in Europe: report from the RARECARE project. Eur J Cancer 2013;49(3):684e95
- Stricker E, et al. Trends in Overall Survival among Patients Treated for Sarcoma at a Large Tertiary Cancer Center between 1986 and 2014. 2023;15(2)
- The WHO Classification of Tumours Editorial Board, WHO Classification of Tumours Soft Tissue and Bone Tumours. 5th ed. Lyon: IARC Press; 2020
- Kalisvaart GM, et al. Personalising sarcoma care using quantitative multimodality imaging for response assessment. Clin Radiol. 2021;76(4):313
- Gronchi A, et al. Soft tissue and visceral sarcomas: ESMO-EURACAN-GENTURIS Clinical Practice Guidelines for diagnosis, treatment and follow-up(). Ann Oncol. 2021;32(11):1348-65
- Kalisvaart GM, et al. Prognostic value of quantitative [18F]FDG-PET features in patients with metastases from soft tissue sarcoma. 2021;11(12):2271–2271. doi: 10.3390/diagnostics11122271
- Kalisvaart GM, et al. A registration pipeline for digitized histopathology and multimodality imaging in sarcoma. Eur J Nucl Med Mol Imaging (2024) 51 (Suppl 1): S1–S1026, S413
- Kalisvaart GM, et al. Design and evaluation of a modular multimodality imaging phantom to simulate heterogeneous uptake and enhancement patterns for radiomic quantification in hybrid imaging: A feasibility study. Med Phys. 2022;49(5):3093–106
- Bonney LM, Kalisvaart GM, et al. Deep learning image enhancement algorithms in PET/CT imaging: a phantom and sarcoma patient radiomic evaluation. Eur J Nucl Med Mol Imaging 52, 3266–3277 (2025). https://doi.org/10.1007/s00259-025-07149-7
Timo Kalisvaart, MD, PhD

Timo Kalisvaart, MD, PhD
12 juni 2025
Leiden
Promotores:
Prof. L.F. de Geus-Oei, MD, PhD
Prof. J.L. Bloem, MD, PhD
Co-promotor:
W. Grootjans, PhD